*Kuch* Kuch*, wat ik allemaal langs zie komen aan reacties.....
De natuur (lees chemie) kent twee soorten reacties (is maar één van de onderverdelingen|) dat zijn thermische reacties en fotochemische reacties. De thermische zijn dan weer onder te verdelen in endotherme (er moet energie in) en exotherme reacties (komt energie uit). Zoiets kan overigens ook in de fotochemie (licht eruit of licht erin), maar dit voert te ver.
Fotochemische en thermische reacties zijn in zijn algemeenheid niet uitwisselbaar: Voorbeeld de fotosynthese in de plant kun je niet uitvoeren door de plant even op te stoken. Dan krijgen we nl. de (exo)therme reactie van het verbranden van hout. Het vuurtje heb je even nodig om de activeringsenergie te overwinnen.
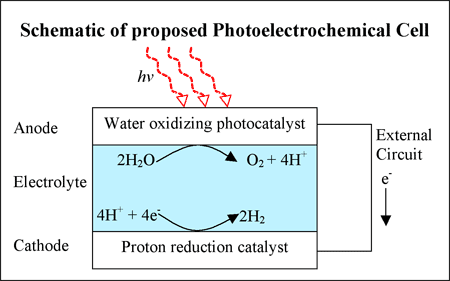
Los van dit hele verhaal heb je oxidatie- en reductiereacties. Vroeger werd oxidatie gezien als alleen maar een reactie met zuurstof (vandaar oxidatie afgeleid van het woord oxygenium, het Latijnse woord voor zuurstof). Tegenwoordig wordt oxidatie en reductie meer in termen van overdracht van elektronen gebruikt. In het figuur hierboven (in het artikel) spreken ze over de oxidatie van water (er worden elektronen onttrokken). Onderin wordt de H
+ via reductie (elektronen worden toegevoegd) omgezet naar H
2.
Oxidatie- en reductieprocessen kunnen zowel bij fotochemische als bij thermische reacties plaats vinden. Hierboven is een voorbeeld van een fotochemische reactie, het roesten van ijzer is een voorbeeld van een thermische reactie.
Het stroompje dat er loopt is dus puur nodig voor de oxidatie- en reductiereactie. Het levert niet/nauwelijks bijdragen aan de benodigde energie, de oxidatie is immers een fotochemische reactie. Fotochemische reacties zijn ook eigenlijk temperatuur ongevoelig (sterk vereenvoudigd!). De reactie wordt geïnitieerd doordat een foton ingevangen wordt en niet door het verhogen van de trilling door temperatuurverhoging.
@ The Zep Man
En ik maar denken dat je voor kernfusie juist waterstof nodig had, i.p.v. dat je er waterstof mee kunt maken

.
@Artikel
Het grote probleem van fotochemische reacties is nog altijd de lage rendementen die we daarmee kunnen halen. De onderzoekers hebben daarom naar de natuur gekeken hoe zaken daar lopen. Voor de duidelijkheid: hun reactie is afgeleid van het natuurlijke proces, hun proces komt in de natuur NIET voor. Bij de fotosynthese wordt uit o.a. CO
2 uiteindelijk zuurstof en koolwaterstoffen (de boom zelf, zal ik maar zeggen) gevormd via een vrij complex proces. Dat hebben ze hier afgekeken, maar op een zodanige manier ingezet dat ze nu zuurstof en waterstof overhouden.
Door het lage rendement van dit soort reacties (zo laag dat ze eigenlijk helemaal niet optreden omdat de reactie "weg-geconcurreerd" wordt) hebben ze een katalysator nodig. Met de katalysator wordt de energiedrempel (activeringsenergie), die de reactie moet overwinnen, verlaagd, waardoor de reactie concurrerend wordt t.o.v. alternatieve reacties.
In een laboratorium lukken dit soort reacties wel. Het probleem zit hem in het opschalen. Je beschikt nl. maar over en klein reactievlak (de anode (met zijn vergankelijke katalysator) en de kathode) wat het (economisch) opschalen al problematisch maakt. Daarnaast vindt de reactie o.i.v. (zon)licht plaats. Als je de zonlicht gaat vervangen door lampen (heel gangbaar in de chemie) dan wordt het opschalen economisch absoluut onhaalbaar. Als je wel echt zonlicht gebruikt, moet je een constructie bedenken dat bij de (grootschalige) reactie ook (overal) zonlicht kan komen. Voorwaar geen sinecure!
Dus naast dat de reactie nog geoptimaliseerd zal moeten worden in het laboratorium, hetgeen jaren kost, zullen de Ir's daarna dat proces nog met succes moeten kunnen vertalen naar een productieproces, hetgeen over het algemeen veel moeilijker is dan bij thermische processen.

:strip_exif()/i/1074097738.jpg?f=fpa)
/i/1331204753.png?f=fpa)
:strip_exif()/i/1100681420.jpg?f=fpa)
/i/1255508507.png?f=fpa)
:strip_exif()/i/1203362676.gif?f=fpa)
:strip_exif()/i/1237230746.gif?f=fpa)
/i/1235380669.png?f=fpa)

/i/1224061917.png?f=fpa)
/i/1217620203.png?f=fpa)
/i/1206009202.png?f=fpa)