Samsung heeft aangekondigd dat het een microbrandstofcel heeft ontwikkeld die geschikt is voor gebruik in mobiele telefoons. Het bedrijf verwacht de eerste mobieltjes die werken op waterstof al in 2010 te introduceren.
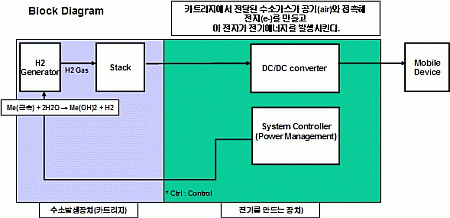
 De micro brandstofcel werkt op water dat met behulp van metaal omgezet kan worden naar waterstofgas. Dit gas kan vervolgens reageren met de zuurstof in de lucht om elektriciteit op te wekken. De door Samsung ontwikkelde brandstofcel heeft, in tegenstelling tot andere brandstofcellen, geen alcohol nodig om waterstof te produceren.
De micro brandstofcel werkt op water dat met behulp van metaal omgezet kan worden naar waterstofgas. Dit gas kan vervolgens reageren met de zuurstof in de lucht om elektriciteit op te wekken. De door Samsung ontwikkelde brandstofcel heeft, in tegenstelling tot andere brandstofcellen, geen alcohol nodig om waterstof te produceren.
Details over de precieze werking van de brandstofcel zijn echter schaars, maar DailyTech denkt dat er mogelijk dezelfde methode van waterstofproductie achtersteekt als de techniek die onlangs aan de universiteit van Purdue werd ontwikkeld, waarbij een legering van aluminium met gallium, indium en tin wordt gebruikt om het gevormde zuurstof te binden waarbij aluminiumoxide wordt gevormd.
Samsung claimt dat de alternatieve energiebron drie watt kan produceren en daarmee een mobiele telefoon tien uur intensief gebruikt kan worden, tweemaal zoveel als mogelijk met oplaadbare batterijen. De tien uur intensief gebruik zou overeenkomen met circa vijf dagen normaal gebruik.
De onderzoekers van Samsung werken aan het makkelijk hervulbaar maken van de brandstofcel. Mogelijk wordt hiermee het opladen van mobieltjes overbodig: simpelweg de mobiel bij de kraan bijvullen zou dan volstaan voor een paar dagen energie. De eerste waterbrandstofcellen zullen echter van waterstofcartridges gebruikmaken, aldus Oh Yong-soo, het hoofd van Samsungs researchafdeling.

/i/1279461272.png?f=fpa)
/i/1249567469.png?f=fpa)
/i/1217066167.png?f=fpa)
:strip_exif()/i/1211054258.gif?f=fpa)
:strip_exif()/i/1203362676.gif?f=fpa)